- Home
- Ordine
- Infermiere e Formazione
- Per gli Iscritti
- Libera Professione
- Modulistica
- News ed Eventi
- Contatti
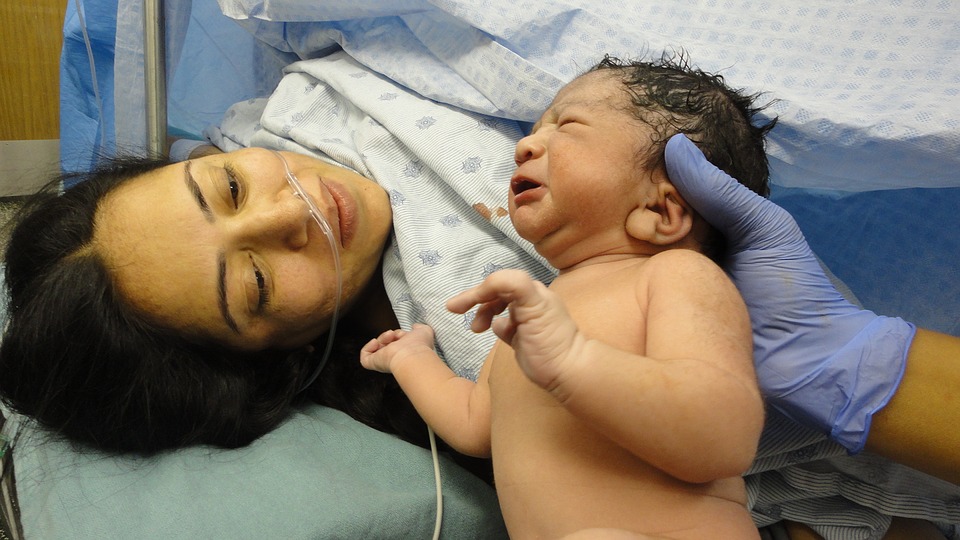
Vi segnaliamo: Giornata Internazionale dell’Ostetrica, in Abruzzo banditi tre concorsi professionali
Il 5 maggio ricorre la Giornata Internazionale dell’Ostetrica. L’Ordine regionale della Professione Ostetrica d’Abruzzo ha programmato diverse iniziative in tutta la Regione. Dall’anno 2020 a tutt’oggi, presso la Regione Abruzzo sono stati banditi ed espletati tre concorsi per Professioniste Ostetriche.
Numerose le attività programmate per favorire il dialogo e la vicinanza alla popolazione femminile e alle loro famiglie al fine di incentivare l’attenzione delle Istituzioni politiche e sanitarie abruzzesi per l’investimento sulla Professionista Ostetrica, figura di riferimento che secondo recenti studi migliora la salute delle madri e dei loro bambini.
Le evidenze ci dicono che la discriminazione di genere e la svalutazione delle donne nel settore sanitario emergono da una mancanza di investimento nella formazione e nella professionalizzazione delle pratiche ostetriche. “Investi nelle Ostetriche” è lo slogan promosso dall’ICM per l’anno 2021, anno che dopo il 2020 l’OMS ha dedicato a tutte le professioni sanitarie. L’investimento nelle Ostetriche deve includere non solo il numero di ostetriche, ma anche l’istruzione, la formazione, la regolamentazione e la tutela dell’ambiente di lavoro.
Troppo spesso la voce delle Ostetrica è esclusa o ignorata durante il processo decisionale, portando a grandi divari di genere nelle leadership e nella realizzazione professionale. L’Ordine regionale della Professione Ostetrica dell’Abruzzo con determinazione mira a far riconoscere in ambito regionale il ruolo delle ostetriche per lo sviluppo di un futuro migliore per la tutela della salute della donna, della sua famiglia e dell’intera Comunità.
Da diversi anni nei contesti assistenziali delle area materno-infantile delle Aziende Sanitarie abruzzesi si sono poste le basi per lo sviluppo del modello organizzativo a conduzione ostetrica che si caratterizza con la presenza di solo personale ostetrico e personale di supporto dedicato. Dall’anno 2020 a tutt’oggi, presso la Regione Abruzzo sono stati banditi ed espletati tre concorsi per Professioniste Ostetriche. Il plauso va alle Istituzioni regionali e alle Aziende sanitarie del territorio abruzzese che quotidianamente investono sul miglioramento degli standard assistenziali della salute femminile e la promozione della natalità...
ANIN webinair 12 Maggio, "Il distress morale degli infermieri al tempo del covid"
 A.N.I.N. Associazione Nazionale Infermieri in Neuroscienze in occasione della giornata internazionale dell'infermiere, 12 Maggio, propone il webinair "Il distress morale degli infermieri al tempo del covid".
A.N.I.N. Associazione Nazionale Infermieri in Neuroscienze in occasione della giornata internazionale dell'infermiere, 12 Maggio, propone il webinair "Il distress morale degli infermieri al tempo del covid".